- How does BT work? – 5 de abril de 2014
- Biology Fortified, Inc.
- Por Joe Ballenger
- Traducido por Susana Grant
La vida, en su nivel más básico es en realidad una serie de reacciones químicas. Los bioquímicos y biólogos moleculares, como yo, observamos cómo funciona la vida en el nivel más básico. Por desgracia, esto es muy complicado y hay pocos recursos en línea para explicar cómo es este trabajo. Anastasia Bodnar tiene una publicación maravillosa de cómo funciona el maíz Bt en las plantas transformadas, titulado simplemente ‘Bt‘. En este post, ella se centra en el funcionamiento de la proteína desde el ángulo de un biólogo vegetal. En este post, voy a discutir la proteína desde el ángulo de un entomólogo.
Específicamente, voy a responder a esta pregunta: ¿Qué sucede cuando una oruga se come la proteína Bt?
Contrariamente a lo que mucha gente piensa, la proteína Bt no es única, ya que es un patógeno de insectos o incluso porque se inserta en una planta. Los patógenos de insectos, a saber, virus, hongos, bacterias y nemátodos, se han utilizado en operaciones de control de plagas. Los insectos que perforan las plantas son frecuentemente controlados por los pesticidas que se incorporan en las plantas, como los neonicotinoides, que se aplican como tratamiento en semillas y se transfiere a la planta a medida que crece. Este método (Bt) no es aplicable sólo a ‘la agricultura convencional’, porque los productores orgánicos inyectan Bt en las plantas para controlar orugas. Además, las plantas tienen sus propios insecticidas que consumimos cuando comemos alimentos. En cambio, la proteína Bt es única porque las toxinas que extraemos de bacterias son a menudo sólo activas contra grupos muy específicos de insectos.
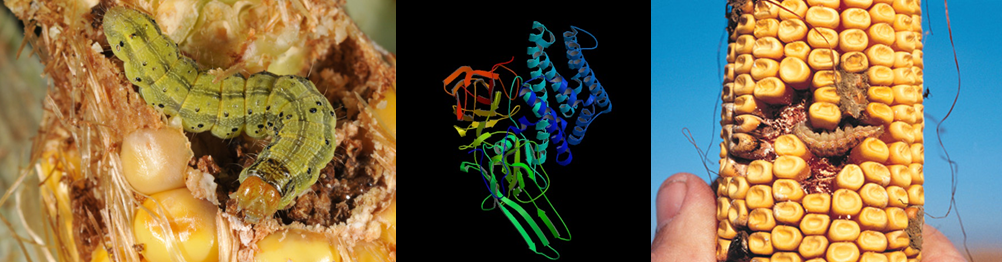
 Las orugas que no comen las proteínas Bt crecen y se convierten en adultos – Imagen: Barrenador del maíz adulto. Por Tony Morris vía Flickr.
Las orugas que no comen las proteínas Bt crecen y se convierten en adultos – Imagen: Barrenador del maíz adulto. Por Tony Morris vía Flickr.
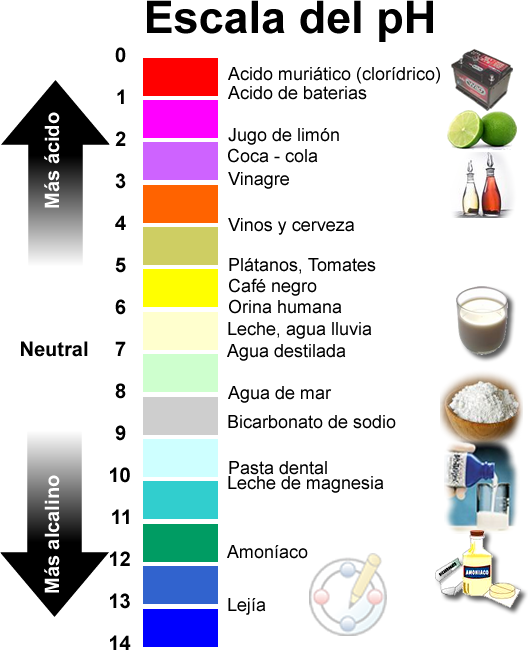
Algunas proteínas Bt funcionan sobre orugas, otras funcionan en los escarabajos. Todas, sin embargo, trabajan en el intestino del insecto. Aunque yo no me centraré en los seres humanos en este post, me gustaría comparar y contrastar los ambientes del pH intestinal entre los intestinos de insectos y humanos. En los seres humanos, la proteína Bt se digiere muy rápidamente in vitro, y esto se debe en parte al hecho de que los estómagos humanos y de insectos son muy diferentes.
Las proteínas son sensibles al medio ambiente, y un factor muy importante es el pH en el cual la proteína se encuentra. El pH ácido del estómago humano es de aproximadamente 2, mientras que el pH del intestino del insecto es de aproximadamente 10. Para que te hagas una idea de lo diferente que estos ambientes son, recuerde que el contacto prolongado con una sustancia muy ácida (pH 2) o muy básica (pH 10) puede dañar el tejido humano, que está en un pH de aproximadamente 7. El daño tisular se produce debido a que el pH local es realmente importante para su función. Si el pH no está dentro del rango adecuado, las proteínas se despliegan y no funcionarán. Cuando esto sucede al tejido humano, el resultado es una quemadura química. La mayoría de las proteínas tienen una ventana de pH relativamente estrecha en la que funcionan, y el Bt no es diferente.
La toxina Bt requiere un pH alto (básico) para ser activo, y debe ser activada por una proteína que corta proteínas que es específica del intestino del insecto. La toxina Bt se compone de un grupo de proteínas pequeñas que trabajan juntas haciendo equipo para formar agujeros en las membranas de las células que forman el intestino. Los agujeros que se forman son pequeños, y permiten que sales y otros solutos pequeños puedan entrar. Cuando las sales entran, el agua les sigue. Cuando el agua fluye a las células estas revientan. Cuando suficientes células revientan, el intestino medio se llena de agujeros grandes. En este punto, el contenido intestinal se derrame en la cavidad del cuerpo del insecto, lo que resulta en la muerte del insecto.
Una guía práctica para los niveles de pH. El estómago humano es tan ácido como el jugo de limón; el estómago del insecto es tan alcalino como el cloro. Haga clic para una imagen más grande. La imagen usada en la publicación original fue remplazada por la que se visualiza por motivos de formato.
Anteriormente, he mencionado un post maravilloso de Anastasia sobre las diferencias entre las proteínas bacterianas y las que están integradas en el maíz. Sin embargo, yo no considero que la proteína codificada por los cultivos transgénicos como la toxina. En lugar de ello, considero que la proteína descrita por Anastasia como parte de la toxina. Recuerde que este gen codifica una proteína, y en el intestino hay múltiples copias idénticas (subunidades) de esta proteína que se conectan entre sí para crear el poro que mata a la oruga. Esto puede parecer una distinción pedante, pero es muy importante para entender cómo funciona esta proteína.
Hay dos diferencias principales entre las proteínas que se encuentran en las bacterias y las proteínas que se encuentran en el maíz . La primera es que en las proteínas bacterianas , hay una subunidad adicional que se ha eliminado en los genes utilizados en los cultivos transgénicos. La segunda es que las bacterias pueden producir múltiples subunidades de proteínas Bt, mientras que el maíz sólo produce una subunidad*. Esto es importante porque las diferentes subunidades pueden interactuar en diferentes combinaciones con diversos efectos potenciales sobre la toxicidad y especificidad .
Hasta ahora, en esta historia, la oruga ha consumido de alguna manera la toxina y si estamos hablando de una toxina derivada de un bacteria, la toxina Bt se ha activado por proteasas de la oruga cortando una parte muy específica de la parte posterior o carbono terminal de la proteína . Lo que tenemos ahora es una proteína que flota en el intestino de la oruga. En el intestino, la proteína no va a hacer mucho daño. Para producir el daño, tiene que bajar a la membrana celular, adherirse otras proteínas y se acercarse a la membrana. Aquí, presentamos otro elenco de factores relacionados:
- Fosfatasas alcalinas: Muchas proteínas se activan y desactivan mediante la adición de grupos fosfato . Bajo las condiciones básicas que se encuentran en el intestino medio del insecto, los grupos fosfato se eliminan de las moléculas por la acción de la fosfatasa alcalina. En los mamíferos, el revestimiento del estómago está protegido por una gruesa capa de moco y el pH de este moco está regulada en parte por la fosfatasa alcalina. Además, la fosfatasa alcalina en los intestinos de mamíferos tienen funciones secundarias que van desde la regulación de la absorción de la grasa a la regulación de reacciones inmunes durante la intoxicación alimentaria bacteriana a la regulación de las interacciones entre nuestro sistema inmunológico y las bacterias beneficiosas. Las fosfatasas alcalinas tienen una gran cantidad de funciones, muchas de las cuales no están relacionados con la digestión.
- Aminopeptidasas: Los insectos consumen variadas proteínas en su dieta, por lo que la digestión implica una gran cantidad de proteínas que digieren otras proteínas. Muchas de ellas están flotando en el líquido intestinal, pero otros se unen a las células intestinales. Algunas proteínas simplemente cortan de manera aleatoria** para acelerar la digestión aumentando el área de contacto. Las aminopeptidasas degradan las proteínas desde el extremo, el “frente” o el nitrógeno terminal de la proteína.
- Las cadherinas: En los mamíferos, estas proteínas, junto con las integrinas, juegan un papel importante en mantener las células juntas. En los insectos, probablemente juegan un papel similar.
Aminopeptidasas, fosfatasas alcalinas, y cadherinas son muy comunes en la pared del intestino. Mientras que la proteína Bt está flotando en el intestino, eventualmente se va a encontrar con las aminopeptidasas y fosfatasas alcalinas. Muy brevemente y muy libremente, se une a estas moléculas. Esta unión probablemente sirve para mantener la proteína en la membrana del intestino hasta que se encuentran con una molécula de cadherina. Mientras que las interacciones son débiles y temporales, la eliminación de la capacidad de Bt para unirse a estas proteínas disminuye en gran medida la toxicidad de estas proteínas. La proteína Bt finalmente se encuentra y une fuertemente a una cadherina.
Mientras Bt se encuentre unida a cadherina, la forma de la proteína cambia, de tal manera que permite a las proteasas en el intestino la corten de una manera muy específica. La forma en que esta proteína se corta expone aminoácidos hidrofóbicos de la proteína. Es como si se generara un parche pegajoso que permite que la proteína Bt pueda unirse con otras subunidades de la proteína Bt. Después de que estas subunidades se enganchan, pierden su capacidad para unirse a la cadherina y, a continuación obtienen la capacidad de unirse fuertemente a aminopeptidasas y fosfatasa alcalinas del intestino. Después de la unión a las aminopeptidasas y las fosfatasas alcalinas, este grupo de proteínas Bt se inserta en la membrana celular y forma un poro.
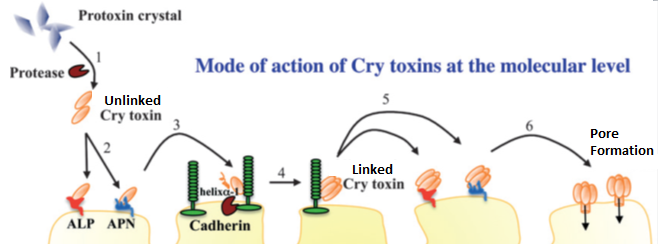
Un diagrama de cómo funciona nuestra comprensión actual de Bt, modificado a partir de Pardo-López et. al 2013. Los pasos son: 1.) La activación de las proteasas. 2.) La unión a las fosfatasas alcalinas (ALP) o Amidopeptidases (APN). 3.) Unión temporal de cadherinas y su posterior procesamiento. 4.) Vinculación a las subunidades. 5.) La unión de las subunidades de los Alpes y el APN. 6.) La formación de poros.
Todavía hay muchas incógnitas acerca de cómo funcionan las proteínas Bt, y realmente nos gustaría entender más estas proteínas para que podamos diseñar nuevas versiones. No entendemos muy bien lo que pasa entre el momento en que la proteína sale de las aminopeptidasas y fosfatasas alcalinas y crea un poro en la membrana celular. También hay algo de debate sobre el número de subunidades que forman una proteína. Estos pueden parecer cosas de menor importancia, pero incluso pequeños avances en nuestra comprensión de cómo funciona exactamente esta proteína provocaría un camino muy grande en nuestra capacidad para utilizar estas proteínas. Por ejemplo, B. thuringiensis puede codificar proteínas de diferentes subunidades que son tóxicas por sí mismas, pero cuando se combinan juntas (Cry1Aa y Cry1Ac para las larvas de la polilla gitana) se sinergias entre sí y pueden llegar a ser más tóxicas que cualquiera de las proteínas por sí sola. La eliminación de ciertas partes de la proteína también puede cambiar la toxicidad. Si pudiéramos encontrar el modo de hacer esto de una manera predecible, podríamos aumentar el número de proteínas creadas por las plantas transgénicas y al mismo tiempo reducir al mínimo el número de genes que tenemos que insertar en la planta. También sería posible predecir cómo los insectos se vuelven resistentes al Bt, y qué modificaciones de la proteína nos permitiría superar esta resistencia. Esto, a su vez, probablemente haría la evolución de la resistencia a los pesticidas de Bt mucho más difícil para plagas de los cultivos.
Así que ahí lo tienen… así es como funciona Bt. Es un proceso muy complicado, pero cuando se comprenden algunos de los detalles bioquímicos en realidad es mucho menos complicado de lo que inicialmente parece. No sabemos todo acerca de cómo funciona la proteína, pero sí sabemos lo suficiente como para ser capaz de utilizarlo. A medida que descubramos más acerca de la proteína, y descubramos nuevas formas de manipular, podremos afinar y perfeccionar esta herramienta para que sea útil en los años venideros.
* El maíz con eventos apilados (stacked) produce dos subunidades diferentes que no se unen entre sí.
** No exactamente de manera aleatoria, los cortes se realizan en aminoácidos específicos. Esto sólo sirve para romper las proteínas en trozos más pequeños para aumentar la velocidad de digestión. Por lo tanto, para nuestros fines y propósitos es todo al azar. En realidad no lo es, pero estas son diferencias pedantes que no tienen importancia para esta discusión.
Trabajos citados
- Harris T.J.C. & Tepass U. (2010). Adherens junctions: from molecules to morphogenesis, Nature Reviews Molecular Cell Biology, 11 (7) 502-514. DOI: 10.1038/nrm2927
- Lallès J.P. (2010). Intestinal alkaline phosphatase: multiple biological roles in maintenance of intestinal homeostasis and modulation by diet, Nutrition Reviews, 68 (6) 323-332. DOI: 10.1111/j.1753-4887.2010.00292.x
- Pardo-López L., Soberón M. & Bravo A. (2013). Bacillus thuringiensis insecticidal three-domain Cry toxins: mode of action, insect resistance and consequences for crop protection, FEMS Microbiology Reviews, 37 (1) 3-22. DOI: 10.1111/j.1574-6976.2012.00341.x



Comentarios Recientes